第1集
非局在化と非局在化効果/酸と塩基/第11章/第12章/第13章/第14章/第15,16章/総合問題
上記のうち、下の演習課題に含まれていないものは応用問題です。
第2集(自習用)
8.非局在化の式と非局在化効果、9.酸と塩基の強さも忘れずに
9.酸と塩基
10.有機化学反応の特徴(2) 「反応論の基本」を一通り学ぶ場合
11.飽和炭素上の求核置換反応
12.脱離反応
13.付加反応
14.芳香族求電子置換反応
17.転位反応と環化反応
18.遊離基(ラジカル)反応
19.酸化還元反応
20.周辺環状反応 :(1)〜(2)は13.付加反応、(6)〜(7)は17.転位反応の範囲。
21.光学分割と不斉反応
NP.天然有機化合物
1.講義資料8-4ページの練習問題(2)〜(5)の非局在化の式を描きなさい。
2.講義資料8-4ページの(b), (c) および練習問題(1), (6)の非局在化の式を描きなさい。
3.講議資料8-8ページの練習問題(3), (6), (9), (10), (12)の非局在化の式を描きなさい。
4.上の「有機化学II・演習問題」の第1集の「非局在化と非局在化効果」をダウンロードし、1.(前回回答した(12)(14)(15)を除く)に答えなさい。
1.次の各化合物の構造式を、酸性が弱いと思うものから順に左から右に並べ、理由を簡単に説明しなさい。
注意:「pKaが大きい(小さい)から」という回答は「同義反復」であり、「理由」を述べたことにはならない。
propanoic acid 3-nitropropanoic acid 2-nitroacetic acid
2.次の各化合物の構造式を、塩基性が弱いと思うものから順に左から右に並べ、理由を簡単に説明しなさい。
aniline (benzeneamine) 4-nitroaniline 2,4-dinitroaniline
3.メタンスルホン酸(CH3SO3H)の酸性について次の各問に答えなさい。
(1) 水中での解離平衡を化学式で答えなさい。
(2) メタンスルホン酸の共役塩基の構造式を描き、なぜこの酸の酸性が強いかを簡単に説明しなさい。
(3) トリフルオロメタンスルホン酸(CF3SO3H)の酸性はメタンスルホン酸よりも強いか、それとも弱いか?理由と共に答えなさい。(やや難しい)
1.次の各反応はいずれも高校の教科書に載るほどよく知られている。示性式または簡略化された構造式を用いてそれぞれを完全な(物質収支の合った)化学反応式で表し、「物質レベルの分類」に従って反応の種類を答えなさい。
(1) エタノールと酢酸から酢酸エチルが生成する。
(2) アセチレン(HC≡CH)と酢酸から酢酸ビニル(CH2=CHOCOCH3)が生成する。
(3) エタノールを酸触媒の存在下で加熱するとエチレンが生成する。
(4) α-グルコースを水に溶かすと、一部がβ-グルコースになる。
(5) アセトアニリドに濃硝酸を作用させるとp-ニトロアセトアニリドが生成する。
2.次の各問いに答えなさい。原子量は小数第二位まで用いて計算すること。
(1) エタノールと酢酸から酢酸エチルができる反応を化学反応式で書きなさい。
(2) エタノール25 g と酢酸30 g から酢酸エチルを合成する時,仮に反応が完全に進行した(収率100%)とすると,生成する酢酸エチルは何mol
か。また,何g か。(「化学反応学」では、これを「理論収量」または「理論量」という。)
(3) (2) の条件で実際に反応を行ったところ,得られた酢酸エチルは27 g だった。酢酸エチルの収率は何%か。
(4) エタノール23 g と酢酸45 g を反応させて,22 g の酢酸エチルを得た。このとき酢酸エチルの収率は何%か。
3.次の各化合物の構造式を描き、求核種(または塩基)および求電子種(または酸)が接近しやすいと考えられる原子を、テキストの例にならって示しなさい。
(1) propene (2) benzoic acid (benzenecarboxylic acid, C7H6O2)
(3) 1-bromobutane (4) aniline (benzenamine)
(5) cyclohexanone (C6H10O) (6) ethyl acetate (ethyl ethanoate, C4H8O2)
4.次の各化学種が求核種か求電子種かを答えなさい。
(1) トリエチルアミン (2) OH-(水酸化物)イオン (3) Fe3+ (4) メタンチオール CH3SH
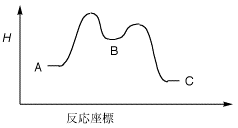
<5.次の化合物AからBを経てCとなる反応について、反応座標の図を参照して以下の問いに答えなさい。

(1) A、B、Cのどれがもっとも安定な化学種か?
(2) この反応は発熱反応か吸熱反応か?
(3) この反応の活性化エネルギーはどこになるか?
(4) Bは、反応中間体か、それとも遷移状態か?
6.(関数電卓が必要)活性化エネルギーが83 kJ/molの反応があるとき、反応温度が50 ℃から60 ℃に変わると、反応速度はおよそ何倍になるか(有効数字2桁)。
7.授業資料10-5の「5) 「速度論支配と熱力学支配」について、適当な例を用いてわかりやすく説明しなさい。
1.次の反応の主生成物の構造と名前を答えなさい。
(1) ヨードメタンにナトリウムエトキシド(CH3CH2ONa)を作用させる。
(2) 1-ブタノールに硫酸酸性下で臭化水素を作用させる。
(3) 2-メチル-2-ヨードプロパンに、氷冷下で水酸化ナトリウム水溶液を作用させる。
2.(1) 主な求核種(あるいは求核種を生じる物質の組み合わせ)を5つ挙げ、求核置換反応を起こしやすい順に並べなさい。
(2)(旧5)主な脱離基を5つ挙げ、求核置換反応が起こりやすい順に並べなさい。
3.上記の演習問題・第11章をダウンロードし、問題1を解きなさい。
4.次の反応の主生成物を構造で答え、その反応の機構を説明しなさい。
(1) (S)-3-メチル-3-ヘキサノール(CH3CH2C(OH)(CH3)CH2CH2CH3)と臭化ナトリウムに濃硫酸を作用させる。
5.問題1の各反応はそれぞれSN1反応、SN2反応のいずれと考えられるか。
(応用)6.上記の演習問題・第11章をダウンロードし、問題2、3,5を解きなさい。
追1.(関数電卓が必要!)活性化エネルギーが83 kJ/molの反応があるとき、反応温度が50 ℃から60 ℃に変わると、反応速度はおよそ何倍になるか(有効数字2桁)。導出過程を含めて答えること。(10章で正解を導出できた人は省略可)
演習なので、必要な定数や計算のための公式がわからなければ信頼できる友人に訊いたり本で調べてちゃんと計算すること。わからない人はTAに聞くこと。
(ヒント)高校で教わったこと 1/ab = a-b abac = a(b+c)
高校に置いたままで大学生をやってはいけない。忘れたら大学生の名誉に賭けて復習して取り返す。
1.次の反応の主生成物を構造で答え、その反応の機構を説明しなさい。
(1) (S)-3-メチル-3-ヘキサノール(CH3CH2C(OH)(CH3)CH2CH2CH3)を濃硫酸と共に加熱する。
(2) (2R,3R)-2-ヨード-3-メチルペンタン(CH3CHICH(CH3)CH2CH3)に水酸化ナトリウムを作用させ、加熱する。
(3) 臭化N,N-ジメチル-N-エチル-N-プロピルアンモニウム(
CH3CH2CH2(CH3CH2)N(CH3)2+・Br-)を水酸化ナトリウム水溶液中で加熱する。
2.上記の練習問題・第12章をダウンロードし、問題1(1)(2)、2を解きなさい。
1.次の反応の主生成物の構造を示し、名前を答えなさい。
(1) シクロペンテンに臭素を作用させる。
(2) 1-メチルシクロペンテンに臭化水素を作用させる。
2.「演習問題・第1集」・第13章をダウンロードし、問題1(1)(2)(5)(7)(8)および問題3(1) を解きなさい。
1.ベンゼンのニトロ化を例として、芳香族求電子置換反応での
(a) 求電子種の生成経路
(b) 反応中間体と反応機構
を詳しく説明しなさい。(基礎有機化学の復習)
2.次の化合物への求電子置換反応が、ベンゼンの場合よりも起こりやすいものの記号を答えなさい。
(a) bromobenzene (b) benzonitrile (benzenecarbonitrile, C6H5CN) (c) toluene (d)
benzoic acid (benzenecarboxylic acid, C6H5CO2H) (e) phenol (f) benzaldehyde
(benzenecarbaldehyde, C6H5CHO)
3.次の各反応の主生成物を答えなさい。
(g) p-メチルアニリンを塩酸酸性下-20℃で亜硝酸ナトリウムと反応させた。
(h) (g) の生成物をアニソール(メトキシベンゼン)と反応させた。
(i) (g) の生成物を、ヨウ化銅(I)の存在下、ヨウ化ナトリウムと反応させた。
質問「亜硝酸によるジアゾ化反応(ジアゾニウムイオンの生成)がどのようにして起っているか」への回答は、Q&Aのページの「芳香族求電子置換反応」のQ4を参照して下さい。
(応用)4.上記の演習問題・第14章をダウンロードし、問題1、7、9、3を解きなさい。
1.次の反応の主生成物の構造を、立体化学がわかるように答えなさい。
(1) 2-ブタノンに水素化アルミニウムリチウムを作用させる。
(2) シクロヘキサノンに塩化水素を作用させる。
(3) ベンズアルデヒド(ベンゼンカルボアルデヒド、C6H5CHO)にCH3CH2MgBrを作用させる。
(4) p-トルエンスルホン酸の存在下で、2-メチルプロパナール((CH3)2CHCH=O)とフェニルヒドラジン(C6H5NHNH2)を反応させる。
2.次の反応の主生成物を構造で答え、その反応の経路(反応中間体など)を式を用いて説明しなさい。
シクロペンタノンと1,3-プロパンジオールとの1:1混合物に触媒量の濃硫酸を作用させる。
(応用)3.上記の演習問題・第15, 16章をダウンロードし、問題1(1)(7)(11)(14)(24)を解きなさい。
4.N-エチルベンズアミド(C6H5CONHC2H5)を塩酸水溶液中で加水分解する反応の経路を、式を用いて説明しなさい。
5.次の各反応を化学反応式を用いて表しなさい。
(1) 塩化アセチル(塩化メタノイル、CH3COCl)と安息香酸ナトリウム(ベンゼンカルボン酸ナトリウム、C6H5COONa)を反応させる。
(2) 安息香酸メチル(C6H5COOCH3)に、乾燥ジエチルエーテル中で十分過剰量の臭化フェニルマグネシウム(C6H5MgBr)を作用させる。
(応用)6.上記の演習問題・第15, 16章の問題1(2)(5)(8)(10)(18)を解きなさい。
1.次の各反応を化学反応式を用いて表しなさい。
(1) 水酸化ナトリウムの存在下でアセトフェノン(C6H5COCH3)に十分過剰な量のヨウ素を作用させる。
(2) ベンズアルデヒド(C6H5CH=O)とアセトンを、ナトリウムエトキシド(EtO-
Na+)の存在下で反応させる。
(3) プロパン酸エチル(Ethyl propanoate)にナトリウムエトキシドを作用させる。
ヒント:2分子のエステルが反応する。
2.次の反応の経路(反応中間体など)を式を用いて説明しなさい。
p-トルエンスルホン酸の存在下で、シクロヘキサノンにヨウ素を作用させると、2-ヨードシクロヘキサノンが生成する。
3.(関数電卓が必要)16-4ページのpKaの表を用いて、次の各問に答えなさい。
(1) 次の化学反応式で表される反応の平衡定数Kを求めなさい。
CH2(COOCH3)2 + CH3O- ⇔ -CH(COOCH3)2 + CH3OH
(2) メタノール100 mL中に0.1 molのマロン酸ジメチル(CH2(COOCH3)2)が溶けているときに、0.1 molのナトリウムメトキシドを加えたとき、平衡状態で解離していないマロン酸ジメチルのモル濃度はいくらか。またはじめに溶けていたマロン酸ジメチルのおよそ何%になるか。ただし、メタノールのモル濃度は31 mol/Lとし、反応を通じて変化しないものとする。
4.次の各反応を化学反応式を用いて表しなさい。
(1) マロン酸ジエチルと1-ヨードブタンをナトリウムエトキシドの存在下で反応させる。
(2) (1)の生成物を希塩酸中で加水分解する。
(3) (2)の生成物を加熱すると気体が発生する。
(応用)5.上記の演習問題・第15, 16章の問題1(3)(15)(19)(21)(23)を解きなさい。
(論述式問題)この問いの回答に期限は設けない。授業が終わるまでの間に、空いた時間を使って回答をまとめればよい。
アルドール反応と付加脱離反応は互いに競争になることがあるかどうか、あるとしたらどのような場合か、考えてみよう。
(考え方)この問題には、一つの正解はありません。反応の起こる条件によって回答は変わって来ます。
(i) まず、それぞれの反応が起こるための条件を明らかにする必要があります。
(ii) その上で、「競争になる」とはどのような時をさすのでしょうか?どちらか一方の反応だけが優先して起こり、もう一方の反応は無視できる程度しか起こらない場合には、「競争になる」とは言えません。この場合には「どちらが優先するか」を明確にしないと、「競争にならない」という結論は出せません。
(iii) そして、一方の反応が優先して起こる反応条件と、他方の反応が優先して起こる反応条件とが明らかになれば、その二つの反応条件の中間にあたる条件下では、どんなことが起こるでしょうか?
(1)反応条件を次の4つの場合に分けて、上記の点を考察して記しなさい。できれば結論を導出しなさい(「どちらともとも言えない」という回答になる場合もあるかも知れない)。
(a) 強塩基性(pHが12より大きい)であり、(2)以上の考察結果に基づいて、はじめの問いに対する回答をまとめなさい。
結論が妥当かどうかよりも、結論に至る考察の過程のほうが重要である。
上に明記されていな条件は、自分で「仮定して」考察してよい。
一人で考えてもいいが、友だち(コラボテストのグループ仲間)や先輩など誰とでも(Zoom、Lineなどを含めて)話し合ったほうがいい。回答には、(TA、教員以外で)相談したり、意見を出し合った人の名前を記すこと。共同で回答をまとめて、連名で提出してもよい。
0.前々回の演習の回答で間違えた問題で、正解を調べて納得できたものの問題番号を記しなさい(空白は不可)。
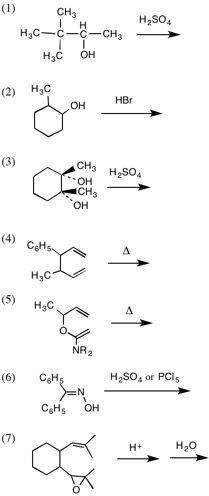
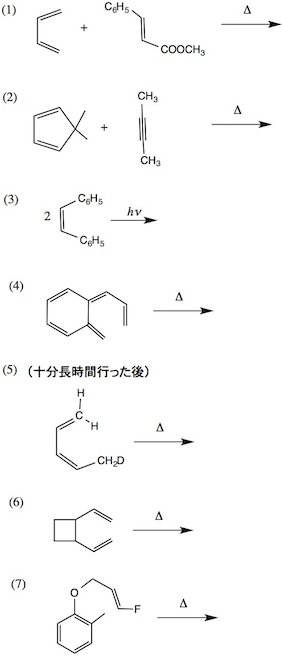
1.次の反応の主生成物を答えなさい。(1)〜(3)(6)では転位する化学種(イオンまたは基)を示しなさい。(7)では、反応中に生成すると考えられる陽イオン中間体(最大3つ)を示しなさい。
2.次の反応の径路(結合の開裂と生成の起る場所、途中で生成する中間体、わかれば遷移状態も)を図式を用いながら言葉で説明しなさい。
3.「20. 周辺環状反応」の問1(6)〜(7)に答えなさい。
1.次の反応の主生成物を答えなさい。((1)は2つ以上答える)
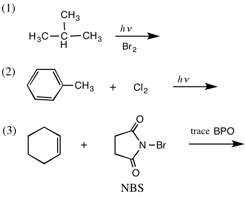
2.次の各反応を化学反応式を用いて表しなさい。
(1) 1-メチルシクロペンテンに、少量の過酸化ジ(t-ブチル)(t-Bu-O-O-t-Bu)の存在下で臭化水素を作用させる。
(2) スチレン(ビニルベンゼン、PhCH=CH2)に、少量の過酸化ベンゾイル(BPO)の存在下で臭化水素を作用させる。
3.「演習問題・第1集」・第13章をダウンロードし、問題1(6)、および問題3(2) (3)を解きなさい。
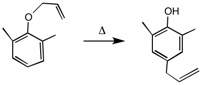
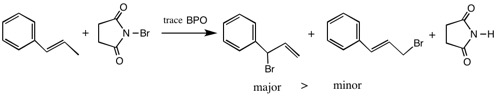
4.1-プロペニルベンゼンとN-ブロモコハク酸アミドを、少量のBPO存在下で反応させたところ、(1-ブロモ-2-プロペニル)ベンゼンが主生成物となった。反応経路を図示して、この理由を説明しなさい。
1.次の化合物の各炭素の酸化準位を求めなさい。
(1) エチン(アセチレン) (2) アセトニトリル(エタンニトリル) (3) エチルアミン(エタンアミン)
2.次の反応の主生成物の構造を示し、名前を答えなさい。
(j) p-キシレン(1,4-dimethylbenzene)に硫酸酸性下で二クロム酸カリウム(K2Cr2O7)を作用させた。
3.「演習問題・第1集」・第13章をダウンロードし、問題1(10)および問題2(2)(4)を解きなさい。
4.次の反応の主生成物の構造を示し、名前を答えなさい。
(1) シクロヘキサノールに酸性条件下で二クロム酸カリウム(K2Cr2O7)を作用させる。
(2) 2-メチル-1-プロパノールに酸性条件下で三酸化クロムを作用させる。
6.次の各反応を化学反応式を用いて表しなさい。有機化合物は構造がわかるように記すこと。
(1) ブタナール(分子式:C4H8O)に酸化銀を作用させる(通常はアンモニア水中で行うが、アンモニアは考えなくてよい)。
(2) CH3COCH2CH2COOCH2CH3に水素化ホウ素ナトリウム(テトラヒドリドホウ酸ナトリウム、NaBH4)を作用させる(反応で生じた塩を水で分解する)。
7.「演習問題・第1集」・第13章をダウンロードし、問題2(1)(3)(5)を解きなさい。
20. 周辺環状反応
1.次の問いに答えなさい(可能な場合は立体化学も明記すること)。
1.次の問いに答えなさい。ただし,旋光度を測定するためのセルの長さは全て10 cm(1 dm)とし,ナトリウムランプ(D
線)を用いて測定したとする。
(1) 1.0 g の(S)-グルタミン酸モノナトリウムの10 mL 水溶液を作り,旋光度(θ)を測ったところ,+2.52°だった。(S)-グルタミン酸モノナトリウムの比旋光度
[α]D はいくらか。
(2) (1)のとき,グルタミン酸モノナトリウムのS 異性体とR 異性体との比が60:40 の混合物1.0
g の10 mL 水溶液の旋光度(θ)はいくらになるか。
2.純粋な(S)-Carvoneの比旋光度[α]Dは+62°である。Carvoneを光学分割して得た(R)-Carvoneと(S)-Carvoneの混合物0.1 gの1 mL溶液の旋光度を、10 cmのセルを用いて測定したところ-3.1°だった。このとき、この混合物の鏡像体過剰率(e.e.)は何%か。また、混合物中の(S)-Carvoneの割合は何パーセントか。
3.2-ブタノンを不斉還元剤を用いて還元したところ、(R)-2-ブタノールが15%、(S)-2-ブタノールが75%の収率でそれぞれ得られた。このとき、不斉収率(鏡像体過剰率、e.e.)は何%か。
天然有機化合物の化学 演習問題(解答例へのリンクは下にある)
名称のみを示した各天然物の構造は、講義資料(あるいは参考書など)を参照しなさい。
1.次の天然物の分類について調べ、各分類に共通する構造や性質の特徴をまとめて答えなさい。
(1) プロスタグランジン (2) テルペノイド (3) フラボノイド
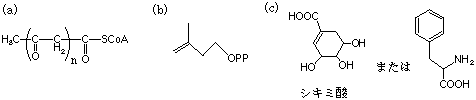
2.次の各天然物の生合成経路で、もっとも適切な前駆物質(合成原料)はどれか、下から選んで記号で答えなさい。
(1) プロスタグランジン (2) エリトロマイシン (3) ステロイド
3.テルペノイドにおける「イソプレン則」について調べなさい。
4.次の各化合物の構造式を描き、イソプレン則に従うものとして、下の例にならって構成単位に分けてみよ。正解が何通りか考えられる場合もあるが、一通りだけ答えればいい。
(例)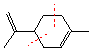
(1) メントール (2) ショウノウ(カンファー) (3) グアイオール (4) タキソール(骨格部分のみを考える。側鎖はすべて-ORなどと描いてよい)。 (5) β-カロテン
5.次の各化合物の生合成経路で、もっとも近い前駆物質(合成原料)はどれか、下から選んで記号で答えなさい(2つ以上が必要な場合もある)。
(1) カフェー酸(コーヒー酸) (2) オーレオマイシン (3) ジベレリン (4) カテキン (5) バニリン
6.次の(1)〜(4)に示した性質に該当する化合物を下から選び、記号で答えなさい。該当する化合物は一つとは限らないし、一つの化合物が複数の性質に該当することもある。
(1) 酸触媒の存在下で酢酸と反応してエステルを生成する。
(2) 酸触媒の存在下でエタノールと反応して、アセタールを生成する。
(3) 炭酸水素ナトリウム水溶液に、気泡を発しながら溶ける。
(4) 水酸化ナトリウム水溶液には溶けるが、炭酸水素ナトリウム水溶液には溶けない。
化合物: (a) レチナール (b) 桂皮酸(cinnamic acid) (c) ケルセチン (d) エストラジオール (e) ジベレリンA14
7.色素、染料などに用いられている有色の天然物はどの分類に属しているか。それらに共通する構造上の特徴を答えなさい。
8.NP14ページの「4.1 窒素を含む複素環化合物」に掲載されている複素環化合物のうち、芳香族性を示さないと考えられるものはどれか、理由と共に答えなさい。
ヒント:芳香族性を示す化合物は、電子数が4n+2個の環状共役系をもっている。
9.アルカロイドに共通の特徴について調べなさい。また、アルカロイドの分類について調べ、まとめて答えなさい。
10.次の各化合物の生合成経路でもっとも重要な前駆物質(合成原料)はどれか、下から選んで記号で答えなさい(2つ以上が該当する場合もある)。
(1) エフェドリン (2) レトロネシン (3) リゼルグ酸(lysergic acid) (4) リコリン (5)
ストリキニン(ストリキニーネ)
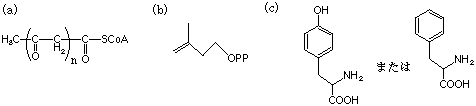
(d) トリプトファン (e) オルニチン
11.次の各アルカロイドの構造式を描き、その分類を特徴づける環構造の部分を赤色または太字で示しなさい。
(1) アトロピン (2) ルピニン (3) リコリン (4) ストリキニン(ストリキニーネ)
12.大多数の補酵素がビタミンと関係があるのに対して、重要な補酵素の一つであるATPがビタミンとは関係がないのはなぜだと思うか。その構造上の特徴に注目してあなたの考えを答えなさい。(この問いには一つの正解があるわけではない)
13.補酵素の関わっている反応が、次の有機化学反応と関係の深い補酵素名またはビタミン名を答えなさい。
(1) クライゼン縮合または活性メチレンの反応 (2) アミノ酸の(不斉)合成
解答例 2、4 5、6 8、10、11、13